Hoy en la sección del Semanario de Investigaciones IB les compartimos la Evaluación Interna de Física Fundamental de nuestro ALUMNI Gabriel Roldán Sogby (2020), quien fue asesorado por el Ing. Luis Fernando Micheo profesor de dicha asignatura y coordinador del Programa del Bachillerato Internacional.
«Diariamente interactuamos con el agua, lo que hace que la veamos como algo tan ordinario y simple, y no nos damos cuenta que es uno de los compuestos más importantes para nuestra existencia. Sin ella la vida sería imposible, aproximadamente el 75% de la superficie del planeta tierra está cubierta por agua y también, alrededor del 60% al 75% de nuestra masa corporal está dada por el agua (Swimtonic, 2018).
Debido a su estructura molecular, tiene propiedades únicas y de vital importancia. Gracias a ellas el agua es considerada como uno de los mejores solventes, esto se debe a la polaridad de sus moléculas que le permiten disolver tanto compuestos iónicos como otras moléculas polares.
Otra propiedad de gran importancia son los enlaces hidrogenados, los cuales almacenan energía calorífica y provocan la capilaridad (las fuerzas cohesivas y adhesivas) que permiten al agua incluso moverse en contra de la fuerza de la gravedad. Estos enlaces de hidrógeno también son los responsables de que el calor específico del agua y su calor de vaporización sean tan elevados en comparación a los demás compuestos pues hacen que la interacción molecular sea fuerte y, por lo tanto, se requieren mayores cantidades de energía para romper estos enlaces y aumentar su temperatura (Azcona, 2012).
Me ha llamado mucho la atención que en la industria, el alto calor de vaporización del agua es de gran importancia pues permite la destilación (Ilustración 1) que es el proceso de separar los componentes o sustancias de una mezcla líquida mediante el uso de la ebullición selectiva y la condensación (Wikipedia, 2020). Esto sirve para producir perfumes, bebidas alcohólicas, agua destilada, purificar el etanol, desalinizar el agua del mar, obtener ácido acético (vinagre), etc.
El agua se evapora a 100°C bajo 1atm de presión. Para que el agua se evapore, las moléculas deben ganar energía cinética para romper los enlaces de hidrógeno y vibrar más para así romper la tensión superficial e incorporarse a la atmósfera en estado gaseoso. Varios son los factores que pueden afectar la evaporación del agua, entre ellos: la energía solar, el calor, la humedad, la presión, las impurezas y el área superficial.
Para leer la investigación completa:
Evaluación:
Este es un trabajo en el que se midió de manera indirecta la relación existente entre el ritmo de vaporización del agua y el área ocupada por la superficie de la misma. Después del correspondiente procesamiento y análisis de los datos obtenidos en el experimento, se encontró que esta relación está dada por la ecuación:
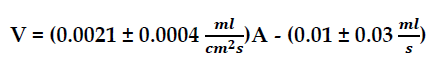
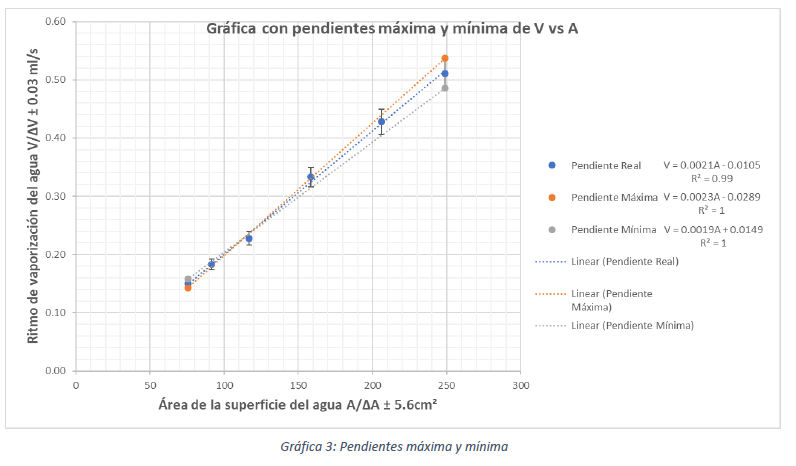
En donde A representa el área de la superficie del agua en cm² y V representa el ritmo de vaporización del agua en ???. Como se puede ver, esta ecuación corresponde a una ecuación lineal de forma y = mx + b y el coeficiente de correlación lineal de la Gráfica 3 es positivo y muy fuerte, con lo que se puede afirmar que el ritmo de vaporización del agua (V) es directamente proporcional al área ocupada por la superficie del agua (A). Lo anterior logra dar respuesta a la pregunta que se ha venido tratando y confirma que la hipótesis planteada es correcta:
“Mientras el área de la superficie sea mayor, más moléculas podrán ganar energía y se evaporarán con mayor rapidez. Por lo tanto, el ritmo de vaporización del agua será directamente proporcional al área de la superficie»
La próxima semana estaremos compartiendo otro trabajo de investigación realizado por uno de nuestros ALUMNI y con el apoyo recibido del profesor de la asignatura elegida por él y que forma parte del claustro en el Programa del Bachillerato Internacional de Colegio APDE El Roble.
#SeFuerteSeRoble #VanguardiayTradición #RezoPorElFinDeLaPandemia